Etiqueta: Editor clásico |
m (Revertidos los cambios de 181.43.129.221 (disc.) a la última edición de VegaDark) Etiqueta: Reversión |
||
| Línea 5: | Línea 5: | ||
== Características == |
== Características == |
||
| − | Exhibe un color amarillo bruto. Es considerado por algunos como el elemento más bello de todos y es el [[metal]] más [[maleabilidad|maleable]] y [[ductilidad|dúctil]] que se conoce. Una onza (31,10g) de oro puede moldearse en una lámina que cubra 28 m<sup>2</sup>. Como es un metal blando, son frecuentes las aleaciones con otros metales con el fin de proporcionarle [[dureza]]. |
+ | Exhibe un color amarillo en bruto. Es considerado por algunos como el elemento más bello de todos y es el [[metal]] más [[maleabilidad|maleable]] y [[ductilidad|dúctil]] que se conoce. Una onza (31,10g) de oro puede moldearse en una lámina que cubra 28 m<sup>2</sup>. Como es un metal blando, son frecuentes las aleaciones con otros metales con el fin de proporcionarle [[dureza]]. |
Además, es un buen conductor del calor y de la electricidad, y no le afecta el aire ni la mayoría de los agentes químicos. Tiene una alta resistencia a la alteración química por parte del calor, la humedad y la mayoría de los agentes [[corrosión|corrosivos]], y así está bien adaptado a su uso en la acuñación de monedas y en la joyería. |
Además, es un buen conductor del calor y de la electricidad, y no le afecta el aire ni la mayoría de los agentes químicos. Tiene una alta resistencia a la alteración química por parte del calor, la humedad y la mayoría de los agentes [[corrosión|corrosivos]], y así está bien adaptado a su uso en la acuñación de monedas y en la joyería. |
||
Revisión actual - 04:16 26 mar 2021
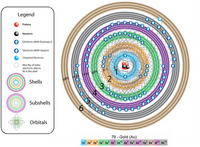
Átomo de Oro.
El oro es un elemento químico de número atómico 79, situado en el grupo 11 de la tabla periódica. Es un metal precioso blando de color amarillo. Su símbolo es Au (del latín aurum).
Es un metal de transición blando, brillante, amarillo, pesado, maleable y dúctil. El oro no reacciona con la mayoría de los productos químicos, pero es sensible al cloro y al agua regia. El metal se encuentra normalmente en estado puro y en forma de pepitas y depósitos aluviales y es uno de los metales tradicionalmente empleados para acuñar monedas. Se utiliza en la joyería, la industria y la electrónica por su resistencia a la corrosión.
Características[]
Exhibe un color amarillo en bruto. Es considerado por algunos como el elemento más bello de todos y es el metal más maleable y dúctil que se conoce. Una onza (31,10g) de oro puede moldearse en una lámina que cubra 28 m2. Como es un metal blando, son frecuentes las aleaciones con otros metales con el fin de proporcionarle dureza.
Además, es un buen conductor del calor y de la electricidad, y no le afecta el aire ni la mayoría de los agentes químicos. Tiene una alta resistencia a la alteración química por parte del calor, la humedad y la mayoría de los agentes corrosivos, y así está bien adaptado a su uso en la acuñación de monedas y en la joyería.
Se trata de un metal muy denso, con un alto punto de fusión y una alta afinidad electrónica. Sus estados de oxidación más importantes son 1+ y 3+. También se encuentra en el estado de oxidación 2+, así como en estados de oxidación superiores, pero es menos frecuente. La estabilidad de especies y compuestos de oro con estado de oxidación III, frente a sus homólogos de grupo, hay que razonarla considerando los efectos relativistas sobre los orbitales 5d del oro.
La química del oro es más diversa que la de la plata, su vecino inmediato de grupo: seis estados de oxidación exhibe –I a III y V. El oro –I y V no tiene contrapartida en la química de la plata. Los efectos relativistas, contracción del orbital 6s, hacen al oro diferente con relación a los elementos más ligeros de su grupo: formación de interacciones Au-Au en complejos polinucleares. Las diferencias entre Ag y Au hay que buscarlas en los efectos relativístas que se ejercen sobre los electrones 5d y 6s del oro. El radio covalente de la tríada de su grupo sigue la tendencia Cu < Ag >- Au ; el oro tiene un radio covalente ligeramente menor o igual al de la plata en compuestos similares, lo que podemos asignar al fenómeno conocido como "contracción relativista + contracción lántanida".
Electrones solvatados en amoniaco líquido reducen al oro a Au-. En la serie de compuestos MAu (M: Na, K, Rb, Cs ) se debilita el carácter metálico desde Na a Cs. El CsAu es un semiconductor con estructura CsCl y se describe mejor como compuesto iónico: Cs+Au-. Hay que resaltar los compuestos iónicos del oro del tipo RbAu y CsAu con estructura tipo CsCl (8:8) , ya que se alcanza la configuración tipo pseudogas noble del Hg (de 6s1 a 6s2) para el ión Au- (contracción lantánida + contracción relativista máxima en los elementos Au y Hg ). El subnivel 6s se acerca mucho más al núcleo y simultáneamente el 6p se separa por su expansión relativista. Con esto se justifica el comportamiento noble de estos metales. La afinidad electrónica del Au, -222,7kJmol−1, es comparable a la del yodo con –295,3kJmol−1. Recientemente se han caracterizado óxidos (M+)3Au-O2-(M = Rb,Cs) que también exhiben propiedades semiconductoras.